JMDCと田辺三菱製薬(株)による、医療機関のデータベース活用事例を考える本座談会。後半は「データベースがどのように活用されるべきか考えてみる」をテーマに、医薬品ライフサイクルで安全性情報の取り扱いの重要度が高まる中、製薬企業におけるデータベース活用の在り方を考えます。
▷参加者
(株)JMDC 寺島 玄氏:Navigator
(株)JMDC 但馬 匠氏
(データ解析担当)
田辺三菱製薬(株) 島﨑 稔氏
田辺三菱製薬(株) 広木俊介氏
▼前編はこちら
 【座談会レポート】医薬品ライフサイクルにおけるデータ活用の実践とこれから(前編)
【座談会レポート】医薬品ライフサイクルにおけるデータ活用の実践とこれから(前編)
ファーマコビジランス部門の業務とデータベースの活用シーン
寺島: 広木さん、島﨑さんはファーマコビジランス部門で安全性情報を収集していらっしゃると思います。どのようなお仕事でしょうか。
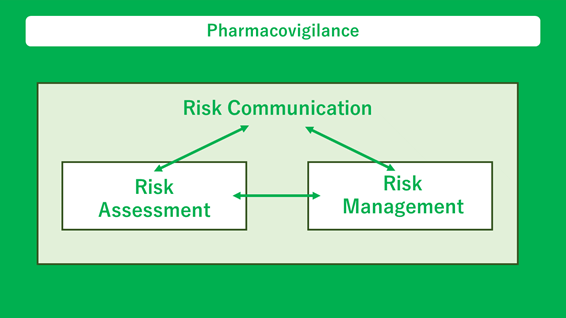
広木: ざっくりお話すると、薬剤の安全性リスク評価、安全性リスクマネジメントを実施しています。さらにこれらの活動の結果を臨床の現場にフィードバックするリスクコミュニケーションの3つを担っています。
リスク評価では、主に医療従事者から報告された有害事象情報に基づく薬剤の安全性評価を行っています。さらに国内では、新薬の発売後に使用成績調査を実施して詳細な評価を行っています。欧米ではPost-authorisation safety studies(PASS)やpost-marketing requirements(PMR)といわれるような市販後の試験を行って安全性リスクの評価を行っています。
安全性リスクマネジメントとコミュニケーションでは、リスク評価で得られた結論をもとに、患者さんや医療機関が薬剤を安全に使用するために必要な情報を資材にまとめます。これらの資材を用いて医療現場の方々に情報をフィードバックさせていただくことで、臨床でのリスク管理を推進しています。
寺島: 安全性業務の中でデータベースを活用できる場面というのはどういうところでしょうか?
広木: 数年前から製造販売後データベース調査という枠組が可能になり、それに伴い、PMDAが疫学調査相談を受けています。この相談で取り扱うのは安全性リスク評価なると思います。新薬の発売後に詳しく評価しなければいけない安全性リスクに対して、今までは使用成績調査という一次データ収集を伴う観察研究が行われていましたが、この部分が医療データベースを用いたデータベース研究で代替できるようになりました。
寺島: 開発段階、承認申請におけるデータ利活用はいかがですか?
広木: 国内ではデータベースを使った薬事手続き・承認申請の事例を聞いたことがありません。米国では、曝露群のデータは一次データを、その対象群のデータを医療データベースのような二次データから持ってきて分析を行い、効能追加の承認申請している事例がFDAの方からいくつか出ていますね。
寺島: ありがとうございます。実際の業務おいてデータを活用することで、どんな変化が起こっていますでしょうか?
広木: ファーマコビジランスでいうと、リスク評価だけでなくリスクマネジメントの領域でデータベースを気軽に使えると感じています。
副作用の問題を臨床現場にどうやって伝えていくのか、あるいは副作用のリスクを最小化するための介入を決める際、臨床現場でどのような特徴を持った人たちがどのように薬剤を使用されているか正確に分からない状況で意思決定せざるを得ませんでした。そのため、時には安全面に配慮しすぎた保守的な判断になってしまうなど、必要十分な安全管理の措置を恒常的に実施するのが難しい状況でした。
現在はデータベースの登場によって、判断に先立って使用者の特徴や薬剤の使用実態を可視化することができるので、不確実性を減らした状態で安全管理の措置に係わる意思決定を行えるようになりました。このような意思決定の場面は実務でたびたび発生しますから、リスクマネジメントの活動で医療データベースを使っていくことは有望だと考えますね。
リスクマネジメントにおけるデータ活用、これまでとこれから
寺島: リスクマネジメントにおけるデータ活用は、これまで経験的なもの、あるいは現場から上がってくる情報で対応していた部分ですよね。
広木:
そうですね。今までは、例えば添付文書に新しい副作用の情報を書き加える、医療機関にハイリスク集団を特定するためにスクリーニングの検査をお願いする等のリスク最小化策を実行して、その影響をしばらくたってから副作用が起こっていないという指標で確認していました。
しかし、我々の考えた最小化策に効果があったかどうか詳しく評価できない状態でした。現在はデータベースの情報から、例えば、検査の実施率と副作用の発生状況に関する時系列データを簡単に得ることができるので、自分たちの行動に対してより踏み込んだ評価ができるようになりました。
寺島: 通常の業務が忙しい中で、追加でデータベースを用いて検討をするというのはリソース的に難しいところもあるような気もしますが、その点はいかがでしょうか?
広木: リスク最小化策の立案、医療現場への浸透及び実行といった安全管理の仕事にもコストがかかるわけですが、これまでは実行した策に効果があったか見られていなかったと思います。客観的かつ評価ができれば、リソースを使って人を動かして意味があったのかなどが正しく分かります。このような評価を定量的かつオンタイムで見ていくことができれば、うまく機能しないときにはやり方を変えたり人や予算の投入量を調整したりするような判断ができるようになります。実行リソースの確保は課題ですが、積極的に進めていく価値はあると思います。

寺島: 実際にそうした動きをする中で、社内の課題はありますか。
広木: 私の所属している組織では、安全管理責任者がデータベースの利活用に前向きです。課題を挙げるなら、意思決定者がデータベースを使ってやりたいことを明確にして、意志決定における影響の範囲を現場に説明していただけるといいですね。
寺島: なるほど。とはいえ、意思決定者が先導しても、現場サイドの担当者がなかなか理解しないということもあるような気もします。データベースの利活用を促進する社内の取り組みも必要ですよね。
広木: データベースの利活用は私たちにとって新しい領域なので、実務プロセスの中である程度使いどころを絞り込んで実務者へ伝えていかないと現場で受け入れていくのは難しそうです。JMDCさんのサービスをはじめとした医療データベースを実務で上手に活用できた事例を蓄積・共有している最中であり、社内で普及活動をしています。
寺島: 事例を作るとそれしかできない印象になるので、「何を調べたいか・知りたいか」という問題意識を持ちながらデータの活用方法をディスカッションする必要があるのかな、と。
広木: 実務の中でクエスチョンを作ること、直面している課題に対して深く考えられることが前提として必要かもしれません。そこにデータベース利活用の考えが加わると「使ってみよう」になると思うのですが。
寺島: データベースで何ができるかという疑問に対して「治療実態を1回調べたらどうですか」と提案することがあります。クエスチョンがなくても集計はできるので、そこからいろんな疑問が出てくることもありますね。
グローバルな視点、多様な視点から考えるデータベースの利活用
寺島:
外資系企業はグローバルが率先して、いわゆる疾患疫学研究をデータベースで行うことが当たり前に行われている気がします。
新しい疾患領域への参入、新しい治療薬の開発、治療ガイドラインの変更による影響などを検討するのにデータを使うケースが多い気がしています。実はそうした情報というのは、医薬品の開発や市販後であろう安全性だろうと、必要な情報は比較的同じ情報源から取得出来ているという状況なのかなと思います。
データを使ってかっこいいことをやらなければいけないような印象がありますが、ベーシックな特徴を出すことだけでも十分だと思います。
広木さんは、海外でいろいろと勉強されている中でいかがでしょうか。
広木: データベース活用の視点で欧州のRisk Management Planのフォーマットを見ていくと、寺島さんのお話にあったコンセプトや内容がちゃんと入っているんですよね。
対象疾患の発症率や有病率はどれぐらいで、さらに重要な併存疾患がどれくらいあるのかなど対象集団の特性についてくわしく書く仕様になっています。承認申請の前段階でそういった重要な特徴を明らかにして、市販後のリスク評価とリスクマネジメントを考える仕組みになっているわけです。
日本のリスクマネジメントプランはそこまで詳細な情報を求めていません。上市準備の時点で投薬の対象となる集団の特徴を欧州ほど詳しく調べていませんが、これは規制の違いだけでなく、国内の状況を詳しく調べる方法があまりなく文献を検索して疾患疫学調査の結果から断片的にしか知ることができなかったからかもしれません。
しかし、現在はデータベースを使って自分で簡単に調査することができます。「じゃあ見てみようか」という発想に変わってもいいのではないかな、と。

私が現在担当している新薬がいくつかありますが、適応症を有する患者さんがもっている合併症や使われている治療薬、年齢や性別の構成を見ると、自分たちがこれからお付き合いしていく集団がどんな人たちなのか、何に困っていそうかが結構見えてきます。
ファーマコビジランスはこのような情報をリスク評価とリスクマネジメントの視点で活用しようと試みますが、マーケティングやメディカルアフェアーズの視点、医療経済の視点などからも、いろいろなことがわかると思います。発売前に多様な視点で対象となる集団の特徴をデータで可視化しておくことは、薬剤のライフサイクル管理を効率的にするための有望な手段ではないかと感じています。
寺島: 患者さんたちがどういう集団なのか把握することは、確かに重要かと思います。お友達や恋人になると言っても、その人が誰かわからないまま仲よくはなれないのと同じですよね。
データベースからの気づき、対話から洞察を見出す
寺島: この間、あるKOLとの面談に同席しました。ある疾患のデータベースで年齢層や合併症のシンプルなデータをお見せしました。それだけでも先生から「こういうことを深掘りしてみたら?」と、いろいろな気づきがありました。「どんな患者さんなの」という情報だけでも、色々と考えられることがあると思います。
広木: 従来の製薬のセールスやマーケティングでは、医療従事者からの聞き取りベースの情報で意思決定することがあったと思いますが、客観的なデータをベースに考察して提案できるように変わってきていると感じます。
寺島: そもそも患者さんを把握するには、かつてはアンケート調査がメインでしたよね。最近、データベースをもとにアンケートを行う、という組み合わせで情報の精度が上がっています。そういったベースの情報として使っていただくというのも、一歩踏み出す上で重要かと思います。
広木: 先程の寺島さんのお話から、KOLの先生がデータにコメントするということは、先生ご自身のなかで疑問を見つけているのではないかと思いました。製薬企業にとってよりどころだったKOLのような方々も客観的なデータを気にしているということは、データベースの利活用は大切ですね。
寺島:
アカデミアの先生にも、データが非常に役に立つという方がいらっしゃいます。もちろん、わかる領域とわからない領域がありますが、これまでの数値よりもデータの数値の方が「自分の肌感覚に合っている」という先生もいらっしゃいます。合っていない場合は解析の手法やデータの選択が間違っているかもしれません。
そういう視点からいろいろな議論ができるので、医療者とのコミュニケーションのひとつとしてもデータベースは使えると思います。

広木: 制度の整備状況からみると、国内では再審査申請等の薬事手続きが動機となっていると思います。規制当局との合意に沿って副作用の発現率や投薬と有害事象の因果関係のような薬剤安全性プロファイルの評価を実施し、もし必要であればさらに論文を書いてリスクコミュニケーションの活動で活用できる、ということが注目されていると感じています。
しかし、製薬企業における利活用のポテンシャルとしては、リアルワールドの可視化によって企業の意思決定における不確実性を減らすことができる点が魅力的です。簡便ですし利用できる場面が日々の業務の中で多くあるので有望ではないかと思います。医薬品のライフサイクルにおけるさまざまなステージで可能性がありそうです。
寺島: JMDCの医療機関のデータ利活用の事例をご紹介した上で、データベースを業務にどのように活用するのか、ざっくばらんにお話をさせていただきました。企業のみなさまと協業を進めて、医薬品の開発やライフサイクルに貢献できればと考えております。
長時間にわたってお話いただきました。ありがとうございました。










.png%3Ffm%3Dwebp&w=640&q=75)



